第45回日本基礎老化学会・早稲田大学人間科学学術院生命科学系合同シンポジウムにおいて研究発表しました。
下川功(代表社員)2024年11月24日、早稲田大学国際会議場、東京
演題名:CR mimeticsの研究開発に向けた取り組み:サポーターからプレイヤーへ
1.研究開発のサポーターとしての経験:
長崎大学在職時に、下川はアカデミア創薬の基盤形成に関わった。つまり大学内の教員、研究者を支援する役割を果たした。2010年代に入り、大学院医歯薬学総合研究科はアカデミア創薬を目指す教育・研究グループを組織した。長崎大学は、創薬を実践、支援する組織として、2012年、先端創薬イノベーションセンターを設置した1)。大学病院では、高い水準において医師主導治験を行えるように臨床研究中核病院を目指すこととした。先端創薬イノベーションセンターには、製薬企業とは異なった独自性が必要であることが議論された。そこで、次世代抗体医薬品であるナノボディーの研究開発能力と、創薬の基盤となるヒット化合物のスクリーニング時に物質特許を取得するための海洋微生物抽出物のユニークなライブラリー構築を目指した。教職員の努力によって、先端創薬イノベーションセンターが有する海洋微生物抽出物ライブラリーはAMED-BINDSの補助事業課題として支援されている。ナノボディの作製設備も整備された。大学病院は、2023年4月、臨床研究中核病院に承認された2)。
このような中で、複数の有力な研究開発プロジェクトが長崎大学では進んでいる。私達、SAGLが注目しているプロジェクトは、先端創薬イノベーションセンター・センター長である田中義正教授が設立した大学発ベンチャー、株式会社SCM (Stem Cell Memory)バイオメディカである3)。田中義正教授は、本庶佑教授(京都大学名誉教授、2018年ノーベル生理学・医学賞受賞)、湊長博教授(京都大学総長)のもとでPD-1-PD-L1免疫チェックポイントの基礎研究に携わった。この研究を長崎大学においてさらに発展させ、「新規PD-1免疫チェックポイント阻害剤併用療法」を考案した。この新規併用療法はがん治療の効率を高くし、副作用が少ないという特徴を持つ。数年後には、治験を目指している。がん治療、がん患者の生存率の向上に大きな役割を果たすと予測される。
2.研究開発のプレイヤーとしての活動:
カロリー制限の老化遅延効果、寿命延伸効果は様々な動物モデルを用いて検証されてきた。ヒトにも応用可能であると推測されているが、ヒトは、社会生活を営む中で、自発的に長期間摂食量を減らすことは困難である。よって、摂食量を減らすことなく、カロリー制限の効果を生み出す方策、物質(Calorie restriction mimetics, CRM)の探索は、老化研究の重要な研究課題の一つである。下川は、長崎大学を辞職後、CRMの研究開発を目指して、2023年1月18日に合同会社SAGLを設立した。
下川は、千葉卓哉(現早稲田大学・教授)、土谷智史(現富山大学・教授)らと共にCRMをスクリーニングする独自のシステムを長崎大学在職時に開発していた4)。このスクリーニングシステムのアイデアは、成長ホルモン(Growth hormone, GH)が欠損するAmesマウスはCRをしなくても、野生型に比べ寿命が延伸する5)、AmesマウスにCRを行うとさらに寿命が延伸することを報告した2つの寿命研究6)に端を発する。CR はGHを抑制することが知られていたので、GH抑制は、CRの老化遅延、寿命延伸メカニズムの重要な要素と考えられていた。AmesマウスのCR研究は、CRの寿命延伸に、GH抑制以外のメカニズムが存在することを示唆した。
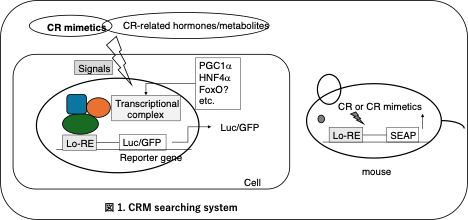
このメカニズムを解明するために、土谷智史は、米国のSpindler教授(カルフォルニア大学リバーサイド校)の研究室で、Ames-CRマウスの肝臓の遺伝子発現解析を行った。その結果、GH抑制とCRによって個別に制御される遺伝子群と相加的に発現が上昇する遺伝子群を同定した7)。土谷は、相加的に発現上昇する遺伝子のプロモーター領域には、GH抑制あるいはCRによって転写因子が結合する共通の遺伝子配列が存在すると予測した。土谷は長崎大学に戻った後、千葉らと共同し、実際に転写因子を含むタンパク質が結合する共通の配列が存在することを明らかにした。さらに千葉は、この配列の下流にレポーター遺伝子を結合させ、GH 抑制あるいはCRによって細胞内シグナルが変化し、転写因子複合体がこの共通配列に結合するとレポーター遺伝子が発現するアッセイシステムを構築した(図1)3)。現在、我々はこの共通配列を長寿シグナル反応性エレメント(Longevity-responsive element, Lo-RE)と呼び、Lo-RE-reporter geneを導入した細胞およびマウスをCRMスクリーニングシステムとして有している。長崎大学創薬イノベーションセンターの海洋微生物抽出物ライブラリーをスクリーニングし、新規CRMの探索プロジェクトを進めている。
3.米国老化研究所の寿命延伸テストプログラム(The Interventions Testing Program (ITP) of National Institute on Aging (NIA))からみたCRM
NIAでは、2002年からマウスの寿命、健康寿命を延伸する作用を持つ物質を同定するプロジェクトを開始した(ITP) 8)。この寿命試験は、遺伝的に多様な背景を持つUM-HET3マウス系統を用いて、ミシガン大学、テキサス大学サンアントニオ校、ジャクソン研究所の3つの施設において行われる。各施設において、オス、メスマウス各50匹が寿命集団として設定される。3施設のデータを統合的に解析することによって、寿命試験における施設環境の影響やマウスの遺伝的背景による影響を極力少なくし、雌雄差を同定できる。外部研究組織あるいは個人が提案した物質と投与法などの計画を、専門家が査読し、毎年4個程度の提案を採択する。現在まで、50種類以上の物質が試験された8)。
この試験は、自由摂食条件で行われるので、オス、メス両方の中央値寿命(50%のマウスが死亡した年齢)あるいは最大寿命(90%のマウスが死亡した年齢)を延伸した物質は、CRMと呼ぶことができるであろう。実際に中央値寿命を延伸した物質は、AspirinやGlycineを含む12種類に及ぶ8)。一方、オス、メス両方の中央値、最大寿命を延伸した物質は、RapamycinとAcarboseだけである。オスの中央値、最大寿命を延伸するが、メスには効果がなかった物質は、17-a-estradiol、16-a-hydroxyestriol 、Canagliflozinの3種であった。
これらの結果は、RapamycinによるMechanistic target of rapamycin (mTOR)系の抑制とAcarbose、Canagliflozinに示されるように血中グルコース濃度の制御は老化や寿命を制御する重要な要素であると推測できる。オスに限られるが、エストロゲン活性が乏しい17-a-estradiolとその代謝産物である16-a-hydroxyestriolによる制御機構も今後の研究課題である。
2000年代に入り、複数の老化制御メカニズムが様々なモデル動物を用いて提唱された。これらの仮説に基づいて行われた寿命試験、例えば、Sirtuinを活性化するResveratrol、酸化ストレスを軽減するCurcumin、老化細胞を除去するFisetinは、有意な寿命延伸効果は証明できなかった。寿命だけが老化のバイオマーカーではないので、これらの物質や仮説の重要性を軽んじてはならない。選択された経路だけに効果があっても寿命自体は延伸されないのかもしれない。CRの寿命延伸効果が認められないマウスの系統も少なくはない9)。今後は、老化を制御する物質を評価する上で、健康寿命の生物学的な定義や老化の多様なバイオマーカーをより明確にする必要がある。
4.Hayashida Financial Management (HFM)とSAGLを中心とした共同研究
我々、HFMとSAGLはすでに8施設の研究グループとの共同研究あるいは研究支援を行い、老化制御研究を推進している。この中で、複数の研究者とITPに共同申請したGlucosamineプロジェクトが採択され、来年には寿命試験が米国において開始される10)。Glucosamineは関節疾患の症状の軽減にサプリメントや処方薬として世界中で広く用いられてきた。Glucosamineが老化や寿命制御に関連していることを示唆する報告が散見される10)。Glucosamineの寿命試験の結果を待ちながら、我々もGlucosamineによる老化制御メカニズムの一端を解明したいと考えている。
引用文献・ウェブサイト
1. https://www.numic.nagasaki-u.ac.jp
2. https://www.mh.nagasaki-u.ac.jp/research/about/
3. https://www.nagasaki-u.ac.jp/ja/news/news4252.html
4. Chiba, T., Tsuchiya T, Shimokawa I., et al. Development of a bioassay to screen for chemicals mimicking the anti-aging effects of calorie restriction. Biochemical and Biophysical Research Communications 401, 213-218 (2010).
5. Brown-Borg, H. M., Borg, K. E., Meliska, C. J. & Bartke, A. Dwarf mice and the ageing process. Nature 384, 33 (1996).
6. Bartke, A. et al. Extending the lifespan of long-lived mice. Nature 414, 412 (2001).
7. Tsuchiya, T. Spindler S.R., et al. Additive regulation of hepatic gene expression by dwarfism and caloric restriction. Physiol. Genom. 17, 307–315 (2004).
8. https://www.nia.nih.gov/research/dab/interventions-testing-program-itp
9. Liao, C.-Y., Rikke, B. A., Johnson, T. E., Diaz, V. & Nelson, J. F. Genetic variation in the murine lifespan response to dietary restriction: from life extension to life shortening. Aging Cell 9, 92 95 (2010).

